Антиангиогенная
терапия:
-
терапия, направленная прямо на ингибирование
процесса ангиогенеза.
Неоангиогенез – формирование сети капилляров из эндотелиальных
клеток, выстилающих мелкие венулы - необходимое условие для дальнейшего роста
опухолевого узелка, достигшего в диаметре 2-4 мм
- строго регулируемый процесс, сбалансированный действием
ряда про- и антиангиогенных факторов, ведущий к формированию новой обширной
сосудистой сети там, где ее раньше не было.
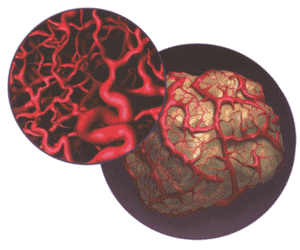
Нормальное сосудистое русло и опухоли.
 Vascular
endothelial growth factor (VEGF) – ключевой медиатор ангиогенеза
один из членов семейства структурно близких между собой
белков, которые являются лигандами для семейства рецепторов VEGF . VEGF
влияет на развитие новых кровеносных сосудов (ангиогенез) и выживание незрелых
кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по
строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и
рецептором-2 VEGF ) и активируя их. Эти рецепторы экспрессируются
клетками эндотелия стенки кровеносных сосудов . Связывание VEGF с
этими рецепторами запускает сигнальный каскад, который в конечном итоге
стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию.
Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция
и вазодилатация, презентация антигенов, а также служат очень важными элементами
всех кровеносных сосудов - как капилляров, так и вен или артерий. Таким
образом, стимулируя эндотелиальные клетки, VEGF играет центральную
роль в процессе ангиогенеза.  VEGF крайне важен в процессе развития
VEGF чрезвычайно важен для формирования адекватной функционирующей
сосудистой системы в ходе эмбриогенеза и в раннем постнатальном периоде, однако
у взрослых его физиологическая активность ограничена. Эксперименты на мышах
показали следующее:
- Целенаправленное
повреждение одной или двух аллелей гена VEGF приводит к гибели эмбриона
- Инактивация VEGF в период
раннего постнатального развития также ведет к летальному исходу
- Повреждение VEGF у взрослых
мышей не сопровождается какими-либо явными аномалиями, поскольку его роль
ограничена развитием фолликулов, заживлением ран и репродуктивном циклом у
самок.
Экспрессия VEGF стимулируется множеством проангиогенных факторов, включая
эпидермальный ростовой фактор, основной фибробластный ростовой фактор,
тромбоцитарный ростовой фактор и интерлейкин-1 б. Кроме того, уровни VEGF
непосредственно регулируются такими факторами окружающей среды, как рН,
давление и концентрации кислорода. Общее влияние этих различных факторов
заключается в опосредованной через VEGF стимуляции важных для ангиогенеза
факторов, включая антиапоптотические белки, молекулы клеточной адгезии и металлопротеиназы
(ММР).
VEGF представляет собой выполнимую терапевтическую задачу.  VEGF поддерживает незрелые сосуды
Незрелые кровеносные сосуды существуют преимущественно на этапе развития, а
у взрослых индивидуумов - лишь в некоторых ситуациях, например, в процессе
заживления ран или заболеваний, характеризующихся аномальным ангиогенезом,
таких как онкологические. В отсутствие ростовых сигналов эндотелиальные клетки
этих незрелых кровеносных сосудов подвергаются программированной клеточной
гибели (апоптозу). VEGF препятствует апоптозу эндотелиальных клеток в незрелых
кровеносных сосудах, тем самым сохраняя их жизнеспособность. В отличие от
этого, зрелые кровеносные сосуды, из которых сформирована сосудистая система
взрослого, больше не нуждаются в VEGF для своего выживания и поэтому вряд ли
будут страдать от подавления активности VEGF.
VEGF стимулирует проницаемость мелких кровеносных сосудов. Повышенная
проницаемость ведет к подтеканию белков плазмы через стенку сосуда и
формированию экстравазального фибринового геля. Этот гель представляет собой
подходящую среду для роста клеток эндотелия. В присутствии высоких концентраций
VEGF, характерных для онкологических заболеваний, сосуды приобретают
чрезвычайно высокую проницаемость и склонность к подтеканию. Следствием этого
является высокое интерстициальное давление в опухоли и неравномерная доставка в
опухоль питательных веществ, кислорода и лекарственных препаратов. Эти
нарушения можно устранить с помощью анти-VEGF терапии.
VEGF стимулирует опухолевый ангиогенез
В отсутствие сосудистой сети опухоли остаются мелкими (1-2 мм). Злокачественные опухоли
подвергаются «ангиогенному переключению», что нарушает баланс между про- и
антиангиогенными факторами, обычно благодаря усилению секреции ростовых факторов.
Многие ростовые факторы, а также низкий рН и низкие концентрации кислорода,
обнаруживающиеся в опухоли, стимулируют экспрессию VEGF, который затем
активирует экспрессию других звеньев ангиогенеза, таких как металлопротеиназы и
молекулы клеточной адгезии. Тем самым VEGF действует как ключевой медиатор
опухолевого ангиогенеза, стимулируя рост новых кровеносных сосудов из
близлежащих капилляров и давая опухоли доступ к кислороду и питательным
веществам, в которых она нуждается для своего роста и метастазирования.
Продукция VEGF стимулируется несколькими внешними факторами.
Каскад VEGF
состоит из ряда сложных и взаимосвязанных сигналов и процессов, которые
запускают ангиогенез. Продукция VEGF
может индуцироваться множественными факторами окружающей среды ( например,
гипоксией и активацией HIV
1 альфа). Важными пусковыми факторами для усиления продукции VEGF опухолью служат также онкогены
(такие как ras, VHL, bcl-2).
VEGF
включает множественные пострецепторные сигналы способствующие процессу
ангиогенеза. Существуют два разных, но структурно близких, рецептора VEGF, расположенных на
поверхности эндотелиальных клеток сосудов. Эти рецепторы, известные как
рецептор VEGF 1 типа и рецептор VEGF 2 типа представляют собой рецепторные тирозинкиназы, которые
после связывания с лигандом VEGF подвергаются
фосфорилированию. Активация этих рецепторов ведет к включению многочисленных
внутриклеточных пост-рецепторных сигнальных каскадов, запускающих опухолевый
ангиогенез.
Прерывание
сигнального каскада VEGF.
Два основных подхода к анти – VEGF терапии включают блокаду либо
лиганда, либо рецептора. Препараты, целенаправленно действующие на лиганд,
связываются непосредственно с VEGF,
продуцируемым опухолью и нейтрализуя его. К препаратам целенаправленного
действия на лиганд относятся антитела к VEGF и растворимые рецепторы, такие как фузионные белки.
Препараты, целенаправленно действующие на рецепторы, связываются с рецепторами VEGF в кровеносных сосудах,
блокируя активацию рецепторов. К этим препаратам относятся антитела к
рецепторам, рибозимы и низкомолекулярные ингибиторы тирозинкиназы.
Основные вехи в развитии антиангиогенной терапии:
-
1971 – Фолкмен публикует гипотезу ангиогенеза
- 1983 – Дворак демонстрирует, что опухоли
секретируют фактор сосудистой проницаемости
-
1989 – Феррара из компании «Genentech» очищает и клонирует VEGF
- 1990-e – начинаются первые клинические испытания специфической
антиангиогенной терапии у онкологических больных
- 2001 - настоящее время – завершены клинические
исследования III фазы
Авастин (бевацизумаб)
- это рекомбинантное гуманизированное моноклональное
антитело (мАТ) к васкулярному эндотелиальному фактору роста (VEGF), который является ключевым
регулятором ангиогенеза опухоли.
Противоопухолевый препарат, представляет собой рекомбинантные гиперхимерные
(гуманизированные, приближенные к человеческим) моноклональные антитела,
которые избирательно связываются с биологически активным фактором роста
эндотелия сосудов (VEGF) и нейтрализуют его. Авастин ингибирует связывание VEGF
с его рецепторами на поверхности эндотелиальных клеток, что приводит к снижению
васкуляризации и угнетению роста опухоли.
Бевацизумаб содержит полностью человеческие каркасные участки с
определяющими комплементарность участками гиперхимерного антитела мыши, которые
связываются с VEGF. Бевацизумаб получают по технологии рекомбинантной ДНК в
системе для экспрессии, представленной клетками яичников китайского хомячка.
Бевацизумаб состоит из 214 аминокислот и имеет молекулярный вес около 149 000
дальтон.
Введение бевацизумаба приводит к подавлению метастатического
прогрессирования заболевания и снижению микрососудистой проницаемости при
различных опухолях человека, включая рак ободочной кишки, молочной железы,
поджелудочной железы и предстательной железы.
Моноклональные антитела
– это иммуноглобулины, полученные на основе гибридомной
технологии, содержащие в структуре домен к соответствующему антигену.
|
1. По строению:
|
|
нативные
|
мышиные
|
|
модифицированные
|
химерные
гуманизированные
|
|
конъюгированные
|
радиоиммуноконъюганты
иммунотоксины
иммуноферменты
конъюганты с цитостатиками
иммунолипосомы
|
|
антиидиотипические
|
вакцины
|
|
2. По механизму действия:
|
|
мАТ, взаимодействующие с АГ опухолевой клетки (прямое
действие)
|
|
мАТ, взаимодействующие с АГ сосудов опухоли
(антиангиогенное действие)
|
|
3. По биологическому взаимодействию:
|
|
Простые мАТ
Биспецифичные мАТ
Триспецифичные мАТ
|
Нативные МКА –
это мышиные иммуноглобулины. Единственным препаратом на основе нативного МКА
17-1А является «панорекс», разрешенный для лечения колоректального рака 2В и 2С
стадий в профилактическом режиме. Эффективность нативных МКА изучалась в
профилактическом режиме при колоректальном раке. Нативные МКА просты в
получении, но являются высокотоксичными, способными к индукции нейтрализующих
антител. В связи с этим они были вытеснены модифицированными
МКА, основное отличие которых заключается в комбинации человеческого и
мышиного белков, в меньшей степени вызывающей образование нейтрализующих АТ.
Так химерные МКА содержат 30-35%
мышиного и 65-70% человеческого иммуноглобулина, гуманизированные - 10% мышиного, и 90% - человеческого
белка. Иммуноконьюгаты представляют
собой комплекс «АТ +дополнительный агент». Они действуют на опухолевые клетки
за счет дополнительного агента комплекса – токсина, цитостатика и тд. Антитело
находит опухолевый антиген, тем самым, доставляя действующее вещество к клетке-мишени.
Поэтому в случае коньюгатов МКА играют роль транспортера. Одним из
распространенных видов коньюгирования является
сочетание радиоактивных изотопов и МКА.
В последнее время спектр препаратов, полученных на основе
коньюгирования, значительно расширился. Появились иммуноферменты ( фермент
транспортируется к опухолевой клетке, на поверхности которой расщепляет
введенный заранее химиопрепарат на активные метаболиты), иммунотоксины
растительного происхождения, конъюгаты цитостатиков и антител (удобный способ
целенаправленной доставки цитостатика к опухоли без влияния на здоровые клетки
организма), разрабатываются методы слияния липосом с цитостатиком и МКА.
Для повышения иммуногенности и эффективности синтезированы биспецифичные и триспецифичные МКА. Биспецифичное
АТ – одним доменом соединяется с опухолевой клеткой, а другим – с
Т-лимфоцитом, сближая расстояние между эффектором и клеткой мишенью. Триспецифичные АТ – участвуют во
взаимодействии опухолевой клетки, Т-лимфоцита и
антиген-презентирующей клетки, тем самым осуществляя контакт между тремя
компонентами одной цепи.
Анти – VEGF терапия оказывает важные эффекты как на новые, так и на
недавно образовавшиеся сосуды.
Анти – VEGF
терапия препятствует пролиферации и миграции клеток эндотелия. Это означает
истинную антиангиогенную активность – подавление роста новых опухолевых сосудов
и развития метастазов. Кроме того, анти – VEGF терапия оказывает существенный эффект на недавно
образовавшиеся кровеносные сосуды опухоли, вызывая апоптоз клеток эндотелия
сосудов, что ведет к снижению сосудистой проницаемости и внутриопухолевого
давления. Эти временные изменения существующего сосудистого русла опухоли ( до
их окончательной деструкции) могут повысить эффективность доставки
цитотоксических препаратов по сосудистой сети в опухоль.
Изменения окружающего сосудистого русла могут сразу же
отразиться на состоянии опухоли.
Редукция кровоснабжения опухоли вследствие обратного
развития опухолевого сосудистого русла приводит к существенному падению
поступления в опухоль кислорода и других питательных веществ. Это, в свою
очередь, уменьшает способность опухоли к росту и метастазированию.
Блокада VEGF и подавление неоангиогенеза злокачественных опухолей:
-
Анти - VEGF терапия подавляет рост новых
опухолевых сосудов и вызывает обратное развитие недавно сформировавшегося
сосудистого русла
-
Анти - VEGF терапия уменьшает сосудистую проницаемость и
внутриопухолевое давление, что может сделать опухоль более чувствительной к химиотерапии
-
Нарушение кровоснабжения опухоли может подавить
ее последующий рост
| 

